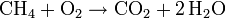Estequiometría
El primero que enunció los principios de la estequiometría fue Jeremias Benjamin Richter (1762-1807), en 1792. Escribió:
La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa en la que los elementos químicos que están implicados.
En una reacción química se observa una modificación de las sustancias presentes: los reactivos se consumen para dar lugar a los productos.
A escala microscópica, la reacción química es una modificación de los enlaces entre átomos, por desplazamientos de electrones: unos enlaces se rompen y otros se forman, pero los átomos implicados se conservan. Esto es lo que llamamos la ley de conservación de la masa, que implica las dos leyes siguientes:
- la conservación del número de átomos de cada elemento químico
- la conservación de la carga total
Las relaciones estequiométricas entre las cantidades de reactivos consumidos y productos formados dependen directamente de estas leyes de conservación, y están determinadas por la ecuación (ajustada) de la reacción.
Ajustar o balancear una reacción
Una ecuación química (que no es más que la representación escrita de una reacción química) ajustada debe reflejar lo que pasa realmente en antes de comenzar y al finalizar la reacción y, por tanto, debe respetar las leyes de conservación del número de átomos y de la carga total.
Para respetar estas reglas, se pone delante de cada especie química un número llamado coeficiente estequiométrico, que indica la proporción de cada especie involucrada (se puede considerar como el número de moléculas/átomos/iones o moles, es decir, la cantidad de materia que se consume o se forma).
Por ejemplo:
En la reacción de combustión de metano (CH4), éste se combina con oxígeno molecular(O2) del aire para formar dióxido de carbono (CO2) y agua. (H2O).
La reacción sin ajustar será:
Esta reacción no es correcta, porque no cumple la ley de conservación de la materia. Para el elemento hidrógeno (H), por ejemplo, hay 4 átomos en los reactivos y sólo 2 en los productos. Se ajusta la reacción introduciendo delante de las fórmulas químicas de cada compuesto un coeficiente estequiométrico adecuado.
De esta manera, si se pone un 2 delante del H2O:
se respeta la conservación para el carbono (C) y el hidrógeno (H), pero no para el oxígeno (O), situación que puede corregirse poniendo otro 2 delante de O2 en los reactivos:
y se obtiene así, finalmente, la reacción ajustada.
Ésta dice que 1 molécula de metano reacciona con 2 moléculas de oxígeno para dar 1 molécula de dióxido de carbono y 2 moléculas de agua.
Este método del tanteo sirve bien cuando la reacción es simple. Consiste en fijar arbitrariamente un coeficiente e ir deduciendo los demás haciendo balances a los átomos implicados en la especie inicial. Si aparecen fracciones, se multiplican todos los coeficientes por el mcm de los denominadores. En reacciones más complejas, como es el caso de las reacciones redox, se emplea el método del ion-electrón.
Se recomienda ir balanceando siguiendo el orden: metales, no metales, hidrógenos, oxígenos.
Coeficiente estequiométrico
Es el coeficiente de una especie química que le corresponde en una ecuación química dada. En el ejemplo anterior:
El coeficiente del metano es 1, el del oxígeno 2, el del dióxido de carbono 1 y el del agua 2. Los coeficientes estequiométricos son en principio números enteros, aunque para ajustar ciertas reacciones alguna vez se emplean números fraccionarios. Es el número de moles de cada sustancia.
Cuando el coeficiente estequiométrico es igual a 1, no se escribe. Por eso, en el ejemplo CH4 y CO2 no llevan ningún coeficiente delante.
FORMULA MATEMATICA
Ecuación química
Interpretación de una ecuación química
Un caso general de ecuación química sería:
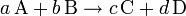
donde:
- A, B, C, D, representan los símbolos químicos de las moléculas ó átomos que reaccionan (lado izquierdo) y los que se producen (lado derecho).
- a, b, c, d, representan los coeficientes estequiométricos, que deben ser ajustados de manera que sean reflejo de la ley de conservación de la masa.
La interpretación física de los coeficientes estequiométricos, si estos son números enteros y positivos, puede ser en átomos ó moles:
Así, se diría de la ecuación de geometría esteqiometrica se subdivide en la siguiente:
1. Cuando "a" átomos (ó moléculas) de A reaccionan con "b" átomos (ó moléculas) de B producen "c" átomos (ó moléculas) de C, y "d" átomos (ó moléculas) de D.
2. Cuando "a" moles de átomos (ó moléculas) de A reaccionan con "b" moles de átomos (ó moléculas) de B producen "c" moles de átomos (ó moléculas) de C, y "d" moles de átomos (ó moléculas) de D.
Por ejemplo el hidrógeno (H2) puede reaccionar con oxígeno (O2) para dar agua (H2O). La ecuación química para esta reacción se escribe:
El símbolo "+" se lee como "reacciona con", mientras que el símbolo "→" significa "irreversible" o "produce". Para ajustar la ecuación, ponemos los coeficientes estequiométricos.
La ecuación está ajustada y puede ser interpretada como 2 mol de moléculas de Hidrógeno reaccionan con 1 mol de moléculas de Oxígeno, produciendo 2 mol del moléculas de Agua.
Las fórmulas químicas a la izquierda de "→" representan las sustancias de partida, denominadas reactivos o reactantes; a la derecha de "→" están las fórmulas químicas de las sustancias producidas, denominadas productos. Los números delante de las fórmulas son llamados coeficientes estequiométricos. Estos deben ser tales que la ecuación química esté balanceada, Es decir, que el número de átomos de cada elemento de un lado y del otro sea el mismo. Los coeficientes deben ser enteros positivos, y el uno se omite. En las únicas reacciones que esto no se produce, es en las reacciones nucleares.
Adicionalmente, se pueden agregar (entre paréntesis y como subíndice) el estado de cada sustancia participante: sólido (S), líquido (l), acuoso (Ac) O gaseoso (g).
En el ejemplo del agua: